
Les principales étapes de la construction
du Soja OGM 40-3-2
Quelles sont les principales étapes du protocole expérimental qui ont permis de réussir la transformation?
- Les plasmides, outils moléculaires de choix pour la transgenèse.
Ce sont de petites molécules d'ADN circulaires, extrachromosomales. Ils sont présents chez de nombreuses souches bactériennes (nombre variable). Leur réplication est indépendante de celle de l'ADN chromosomique. Ils peuvent être facilement manipulés (enzymes); ainsi, on peut couper certaines séquences inutiles (ou gênantes) et insérer des séquences étrangères d'intérêt. Les plasmides modifiés sont des vecteurs de transgène(s) faciles à utiliser pour transformer les bactéries (voir TP "transformation bactérienne" site SVT Lycée).
- Les caractéristiques d'un plasmide-vecteur construit pour la trangenèse végétale.
Un plasmide construit pour transférer un gène d'intérêt comporte la séquence codante de ce transgène flanquée des séquences qui règlent son expression dans les cellules réceptrices, le promoteur et le terminateur.
Le promoteur est une portion d'ADN sur laquelle se fixe l'ARN polymérase et qui contrôle l'initiation de la transcription alors que le terminateur est une séquence qui contient les informations nécessaires pour diriger la maturation de l'extrémité 3' de l'ARNm.Les 2 séquences ne sont pas exprimées dans la protéine codée. Pour qu'un gène procaryote puisse s'exprimer dans une cellule eucaryote, il faut lui adjoindre un promoteur et un terminateur qui puissent être fonctionnels dans la cellule réceptrice. Le terminateur NOS3' est souvent utilisé, c'est celui du gène Nos qui code la nopaline synthase de Agrobactérium tumefaciens, il est fonctionnel dans les cellues végétales. Il faut préciser que cette bactérie, pathogène pour certaines plantes, transfère naturellement une partie d'un plasmide particulier vers le noyau des cellules qu'elle infecte. L'ADN correspondant qui comprend le gène Nos est intégré au génome des cellules hôtes qui le transcrivent en utilisant le terminateur NOS3'.
Le plasmide doit pouvoir être cloné dans une bactérie (E. coli), il doit posséder une séquence (ori) d'initiation de la réplication et un gène de résistance à un antibiotique pour la sélection des transformants. Le vecteur doit également transférer un gène rapporteur qui s'exprime dans les cellules des plantes pour le criblage des transformants.
L'entrée des plasmides ainsi construits dans les cellules végétales peut se faire par bombardement des cellules cibles avec des microbilles d'or enrobées de molécules de plasmides. Dans le cytoplasme, on retrouve des fragments de plasmides qui peuvent ensuite s'intégrer au génome de la cellule hôte.
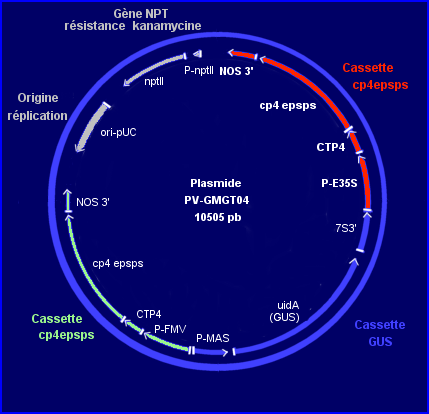
Le vecteur de transgenèse : le plasmide PV-GMGT04
Le plasmide vecteur de la transformation est ici une construction génétique qui comprend:
- 2 cassettes avec le gène d'intérêt cp4epsps, les séquences qui contrôlent son expression (promoteur et terminateur) et la séquence CTP4 (de Petunia hybrida) qui code le peptide d'adressage au chloroplaste.
La séquence codante cp4epsps vient du génome de la bactérie du sol Agrobactérium tumefaciens souche CP4. Le promoteur P-E35S (CaMV35S) de l'une des cassettes cp4epsps est celui du gène 35S du virus de la mosaïque du chou-fleur, c'est un promoteur fort, constitutif, fonctionnel dans les cellules végétales. Celui (P-FMV) de l'autre cassette est très proche. Le terminateur (signal de polyadénylation) des 2 cassettes cp4epsps est NOS3'.
- la cassette
avec le gène rapporteur GUS qui code la b glucuronidase de E. coli (promoteur d'un gène d'agrobacterium tume. et terminateur d'un gène de soja). Un test histologique colorimétrique permet de sélectionner les plantes transformées. En effet, en présence d'un substrat approprié fourni, la b glucuronidase libère un produit qui forme un précipité bleu in situ, révélant la présence de l'enzyme donc l'expression du gène étranger.
- le gène de résistance à l'antibiotique kanamycine (et son promoteur) qui ne s'exprime que dans la cellule bactérienne.
- l'origine ori indispensable pour la réplication du plasmide dans la cellule d'Ecoli.
Du plasmide PV-GMGT04 au Soja OGM 40-3-2
Plasmide vecteur PV-GMG04 cloné dans E. coli |
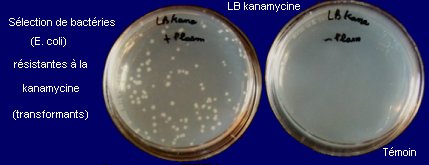 |
Sélection des transformants (résistants à la kanamycine) |
|
Extraction, purification du plasmide cloné PV-GMG04 |
|
Transformation de cellules embryonnaires de Soja |
Bombardement des cellules avec microbilles enrobées de molécules de plasmide PV-GMG04 |
Culture in vitro des cellules traitées de Soja Prolifération (cals clonaux), différenciation (bourgeons) |
Les cellules qui ont été bombardées sont placées sur un milieu de culture approprié (hormones végétales) |
Sélection des transformants (R0) par le test histochimique GUS |
Gus screening : la plupart des bourgeons régénérés donnent un résultat négatif. |
Régénération de plantes matures à partir des transformants (bourgeons sélectionnés). Cultivar R0 |
Développement in vitro, à partir des bourgeons (milieu adapté) puis culture en serre |
Reproduction sexuée des plants R0 sélectionnés Production de graines à l'origine du cultivar R1 |
|
Sélection de plants R1 présentant une bonne résistance au glyphosate |
|
Reproduction sexuée des plants R1 sélectionnés Graines qui fournissent la descendance R2 |
|
Sélection des plants R2 exprimant une très haute résistance au glyphosate (homozygote pour le transgène d'intérêt). Cultivar 40-3-2. |
 |
Evaluation en champs du cultivar 40-3-2 , à l'origine de trés nombreuses variétés transgéniques |
|
La lignée transgénique 40-2-3 possède la cassette d'expression cp4epspe à l'état homozygote, mais a perdu le gène de résistance à la kanamycine et la cassette GUS, pourtant présente dans le cultivar R0 (ségrégation génétique). |
|