|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Origine du grain de pollen
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- L'anthère siège de la formation du pollen
- De la cellule mère du pollen aux microspores : la méiose
- Des microspores aux grains de pollen |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
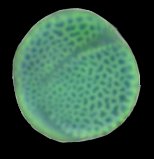
Grain de pollen |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
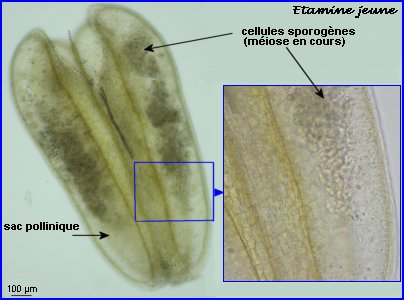
Méiose en cours
(Moutarde, n=9)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
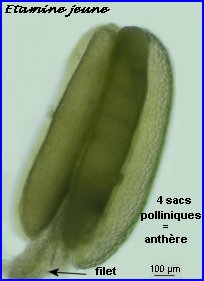
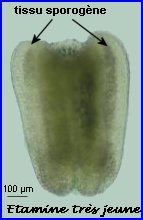
Anthère jeune, siège de la formation du pollen
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Microspores |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Déhiscence longitudinale de l'anthère mûre
|
|
|
|
|
|
|
|
L'anthère siège de la formation du pollen
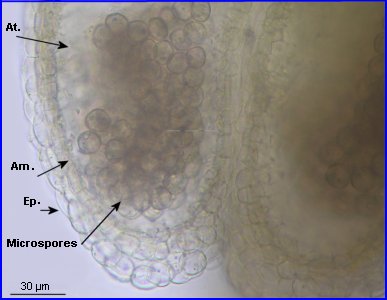
Dans la très jeune étamine, le tissu sporogène à l'origine des grains de pollen est constitué par 4 amas cellulaires allongés longitudinalement, un dans chaque sac pollinique de l'anthère en formation. Ce tissu sporogène comprend de grandes cellules diploïdes. Ces cellules sont à l'origine de microspores qui elles-mêmes se différencieront chacune en un grain de pollen.
A maturité, l'anthère comprend 2 loges polliniques, chacume résultant de la fusion de 2 sacs polliniques. Chaque loge contient de nombreux grains matures, s'ouvre par l'intermédiaire d'un sillon longitudinal de déhiscence et libère son contenu.
At = assises transitoires, Am = assise mécanique en cours de différenciation, Ep = épiderme
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
| De la cellule mère du pollen aux microspores : la méiose |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
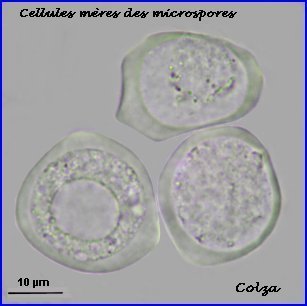
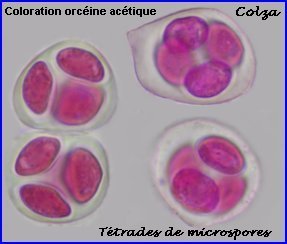
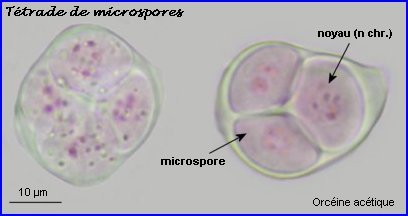
Les cellules mères des microspores (microsporocytes) s'entourent d'une épaisse couche de callose (polysaccharide) que l'on retrouve autour des microspores à l'issue de la méiose (tétrade).
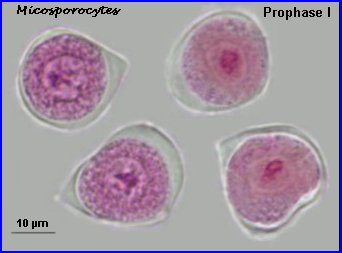
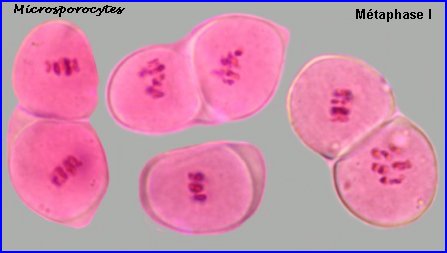
Au lycée, il est difficile de repérer les chromosomes méiotiques dans des préparations réalisées avec les cellules de Colza car ils sont trop nombreux et très petits (2n = 38 avec 9 paires provenant du chou Brassica oleacea et 10 paires de la navette Brassica rapa). On peut utiliser une autre brassicacée par exemple la moutarde, Sinapis arvensis (2n=18) et colorer les chromosomes avec l'orcéine acétique (ici sans fixation préalable). |
|
|
|
|
|
|
1ère division de méiose (Sinapis arvensis) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
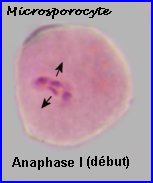
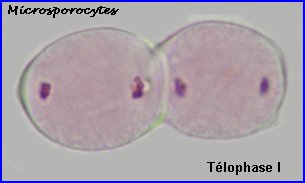
A la prophase I, chaque cellule mère des microspores (microsporocyte) possède 2n chromosomes à 2 chromatides chacune (la phase de réplication de l'ADN a eu lieu). A l'anaphase I, il y a séparation des chromosomes homologues à 2 chromatides et migration d'un lot haploïde vers chaque pôle, à la télophase I, il n'y a pas de cloisonnement. |
|
|
|
|
|
|
|
|
|
|
|
2ème division de méiose (Sinapis arvensis) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
 |
|
|
|
|
|
|
|
|
|
|
 |
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
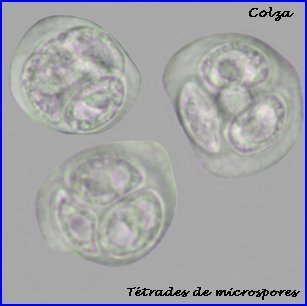
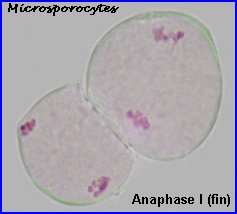
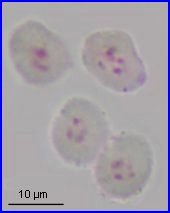
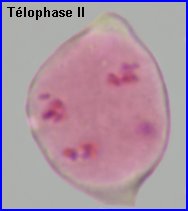
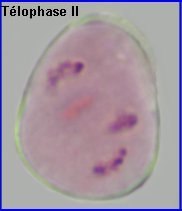
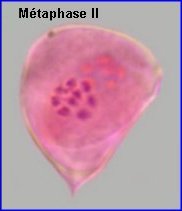
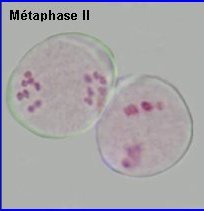
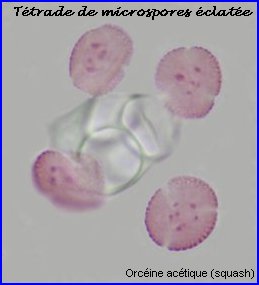
La plaque équatoriale en vue polaire (métaphase II) permet, sur l'image de gauche ci-dessus, de repérer l'ensemble des n = 9 chromosomes (chacun possède 2 chromatides). L'orientation des fuseaux de division, , non repérables ici, définit le mode de disposition des microspores selon un tétraèdre (comme chez la plupart des Dicotylédones). Il est donc impossible d'effectuer une mise au point nette, en une seule fois, sur les 4 lots de n chromosomes correspondant aux microspores, à la fin de la télophase II. La cytodiérèse concerne les 4 futures microspores simultanément.
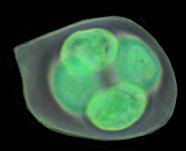
L'image de droite montre les 4 microspores haploïdes extraites par squash de leur enveloppe commune (callose), la méiose venant de s'achever.. |
|
|
|
|
|
|
|
|
|
|
|
Des microspores aux grains de pollen |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
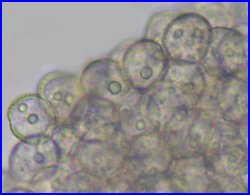
- Evolution des microspores restées en tétrade |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
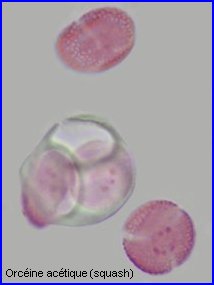
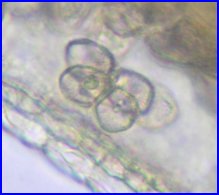
Les 4 microspores issues de la méiose étant individualisées, les cloisons qui les séparent s'épaississent (callose). Les 4 cellules,qui forment un tétraèdre, sont toujours enfermées dans la paroi de l'ancienne cellule mère. Il est possible de les extraire en appuyant sur la lamelle (squash). On observe alors que la différenciation des microspores avec mise en place de l'exine (constituée essentiellement de sporopollenine) , l'intine (composés pectiques et cellulose), les apertures commence alors que les 4 cellules sont encore dans l'enveloppe de l'ancienne cellule mère. |
|
|
|
|
|
|
|
|
|
|
|
- Des microspores séparées aux grains de pollen |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
La callose qui enveloppe et sépare les microspores est dégradée par une enzyme (callase) produite par un tissu différencié (tapis) dans chaque sac pollinique. Les microspores désolidarisées possèdent déjà une intine et une exine, chacune va évoluer en grain de pollen. L'image de gauche montre une ancienne tétrade dans le sac pollinique, celle du centre, un ensemble de microspores après dégradation de la callose, celle de gauche, 3 stades de l'évolution de la microspore en grain de pollen marquée par une augmentation de taille, un épaississement de l'exine et la formation temporaire de vacuoles qui vont fusionner en une grande vacuole qui repoussera le noyau vers la marge.
Ces images ne rendent pas compte des divisions qui se déroulent dans la dernière phase de formation du grain de pollen, elles ne seront pas ici décrites en détail mais seulement évoquées à partir des images (ci-dessous) de grains matures colorés par l'orcéine acétique. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
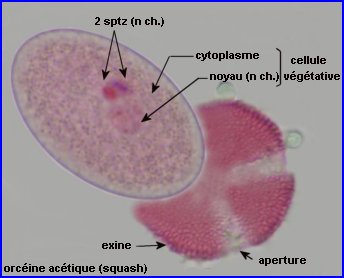
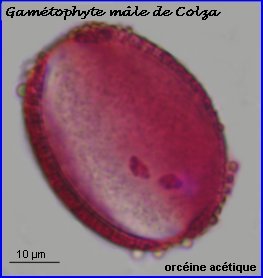
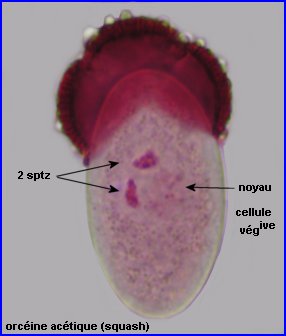
On peut repérer, à travers l'exine du grain intact, 2 noyaux colorés, chacun appartenant à un spermatozoïde (à gauche).
Le contenu du grain, séparé de l'exine par squash, montre la présence, en plus des noyaux des sptz, du noyau de la cellule végétative, à chromatine moins dense (à droite).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
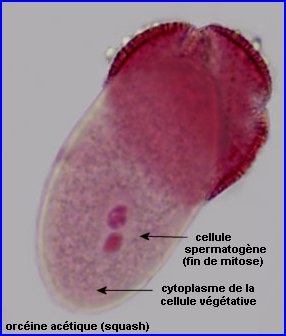
A l'issue de la phase de vacuolisation, une grande vacuole repousse le noyau de la microspore vers la périphérie. Il y a alors une mitose inégale avec formation d'une petite cellule fusiforme contre l'intine, la cellule sporogène haploïde et d'une grande, la cellule végétative, également haploïde. Cette étape n'apparaît pas, ici, sur les images.
Ensuite, la cellule spermatogène se retrouve incluse dans le cytoplasme de la cellule végétative et subit une mitose qui conduit à la formation de 2 petites cellules haploïdes, les gamètes mâles ou spermatozoïdes (voir images ci-dessus).
Le grain de pollen mature est un gamétophyte mâle. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |






























