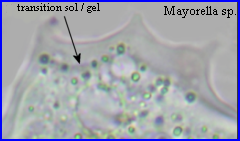
Actine-dépendance des mouvements amiboïdes
et de la phagocytose
Cas des Amibes
Les observations réalisées (voir autres pages) montrent l'intervention des pseudopodes dans le déplacement et dans la nutrition par phagocytose des amibes. Quand un pseudopode se forme et s'étend, qu'il soit locomoteur ou qu'il participe à l'internalisation d'un aliment, il y a une avancée de la membrane plasmique et l'arrivée à son niveau de cytosol endoplasmique fluide (sol) qui devient plus consistant (gel) et remplit la protrusion. La transition sol/ gel est réversible.
Des données expérimentales mettent en évidence l'actine dépendance des mouvements amiboïdes et de la phagocytose, l'actine étant un acteur moléculaire central dans la formation des pseudopodes. Comment intervient-elle?
L'actine, protéine hautement conservée, est présente dans les cellules de tous les Eucaryotes sous une forme monomérique (G) cytosolique en équilibre dynamique avec une forme polymérisée (F) qui constitue des microfilaments cytosquelettiques. Voir aussi TP "Protéines musculaires" et TP "Cyclose"
Les filaments d'actine sont le siège de perpétuels remaniements par gain (polymérisation) ou perte (dépolymérisation) de monomères.
L'assemblage et le désassemblage des filaments dépendent de la concentration cytosolique du monomère et des interactions que l'actine établit d'une part avec l'ATP/ADP et d'autre part avec diverses protéines qui intéragissent avec les formes G ou F.
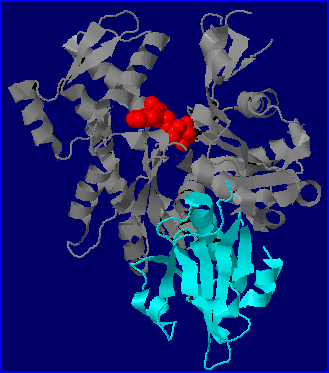
Parmi les nombreuses protéines liant l'actine (Actin Binding Proteins= ABPs), certaines favorisent l'assemblage (ex: la profiline), d'autres la mise en place de ramifications (ex: le complexe ARP2/ARP3), d'autres encore bloquent les monomères (ex: la thymosine) ou déstabilisent les filaments (ex: la cofiline) ou encore les fragmentent ( ex: la gelsoline). Des ABPs sont présentes chez tous les Eucaryotes. Chez l'amibe Dictyostelium discoideum, modèle prisé pour l'étude de la dynamique de l'actine (aussi bien dans le cadre de la motilité que dans celui de la phagocytose), on retrouve les mêmes familles d'ABPs que chez les Mammifères avec certaines protéines qui présentent une forte similarité avec leurs homologues humains. Sur le modèle moléculaire (fichier 1nm1.pdb), on voit qu'un fragment de gelsoline humaine (domaine S1) peut se lier à un monomère d'actine de Dictyostelium.
Quelques données expérimentales
-Des courants cytoplasmiques avec changements d'état "sol/gel" ont été obtenus dans des extraits de cytoplasme d'amibe, en présence de Ca2+ et d'ATP.
-Le déplacement et la phagocytose des amibes sont réversiblement inhibés par la cytochalasine B qui perturbe la polymérisation de l'actine.
-La locomotion de l'amibe sociale Dictyostelium dépourvue de myosine II (gène inactivé) est perturbée, les pseudopodes se développent bien mais la phase de traction est plus lente que chez Dictyostelium de type sauvage qui possède de la myosine II surtout dans la partie arrière de sa cellule.
-L'actine est présente dans toute la cellule mais les microfilaments qu'elle forme par polymérisation, mis en évidence par l'intermédiaire de marqueurs spécifiques fluorescents, sont surtout repérables dans le cortex, juste sous la membrane plasmique et dans les pseudopodes en formation où ils s'associent en réseaux tridimensionnels formant un gel d'où sont exclus les organites à membrane.
L'implication de l'actine dans le déplacement des amibes
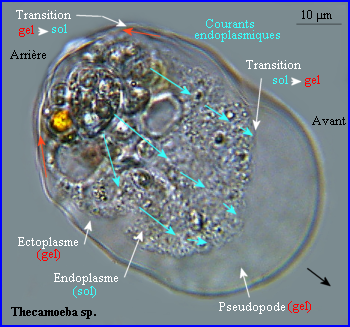
Les mouvements amiboïdes sont liés à des changements réversibles de viscosité du cytosol (voir Déplacement).Ces changements d'état (sol /gel) dépendent du degré de polymérisation de l'actine.
Ainsi quand il se forme un pseudopode, le réseau périphérique sous-membranaire (ectoplasme, qui donne sa forme à la cellule)) sert d'appui à la formation de nouveaux microfilaments ramifiés d'actine qui poussent vers l'avant la membrane plamique, puis le réseau d'actine polymérisée remplit rapidement la protrusion (gel), l'apport de monomères étant assuré par les courants de cytosol endoplasmique fluide (sol) qui s'écoulent vers le front de la cellule. Au niveau d'un pseudopode, des contacts nouveaux s'établissent avec le support par l'intermédiaire de protéines transmembranaires reliées au réseau interne d'actine alors qu'à l'arrière d'anciens contacts sont perdus, une contraction postérieure (intervention d'une myosine) faisant progresser l'ensemble de la cellule. Le réseau d'actine évolue de manière dynamique. A l'arrière de la cellule où l'ectoplasme repasse à l'état sol, il y a dépolymérisation (désassemblage) alors qu'il a polymérisation (assemblage) à l'avant ...
Quels sont les signaux qui influent sur la dynamique du système actine et orientent le déplacement?
Le déplacement de Dictyostelium le long d'un gradient d'AMPc a été bien étudié. On peut supposer que le chimiotactisme intervient également pour d'autres amibes et qu'il est déclenché par un stimulus chimique (inconnu) inégalement réparti dans l'environnement de la cellule. La molécule responsable du signal peut se fixer sur un récepteur membranaire ce qui active des voies de signalisations intracellulaires ayant pour cibles les protéines liant l'actine. Ainsi dans une zone membranaire bien exposée au signal, il se formera de nombreux complexes "molécule signal / récepteur" ce qui induira des réactions intracellulaires en cascades avec pour effet local l'évolution du système "actine" vers la polymérisation (gel, pseudopode) alors qu'à plus grande distance il y aura dépolymérisation (sol). La réception du signal entraîne donc la mise en place d'une polarité structurale et fonctionnelle de la cellule avec un avant où se trouve le (ou les ) pseudopode locomoteur et un arrière. L'orientation du (ou des) pseudopode détermine la direction du déplacement, ici, vers le signal.
L'implication de l'actine dans la phagocytose pratiquée par les amibes
Des signaux chimiques (peut-être des stimulis mécaniques) portés ou libérés par la particule alimentaire activent, par l'intermédiaire de récepteurs membranaires, des voies de signalisation intracellulaires qui stimulent la polymérisation de l'actine et la formation de pseudopodes. On retrouve ici de nombreux acteurs moléculaires (protéines, phosphatidylinositol bi / triposphates* membranaires...) déjà impliqués dans les voies de signalisation qui déclenchent la naissance et l'extension des pseudopodes locomoteurs.
Il y a également des intermédiaires et des effecteurs moléculaires spécifiques qui interviennent pour permettre aux pseudopodes de former une coupe et de fusionner pour fermer le phagosome.
Voir vidéos "internalisation".
* PIP2 / PIP3 : passage possible de l'un à l'autre (réactions enzymatiques)
L'amibe utilisée exprime deux transgènes. L'un code la protéine de fusion PHcrac-GFP qui se lie à PIP3 (mais ausi à PIP2) par son domaine PHcrac et qui peut émettre une fluorescence verte par sa partie GFP. L'autre code la protéine de fusion mRFP-LimEdelta qui marque les filaments d'actine et peut émettre une fluorescence rouge par sa partie RFP.
La coupe progresse le long de la levure, passe au delà de la constriction puis les pseudopodes se rétractent jusqu'à la jonction cellule-bourgeon. Là , au niveau du resserrement (partie concave), il y a accumulation d'actine polymérisée (forte fluorescence rouge) puis désassemblage (disparition de la fluorescence rouge)et la coupe reprend sa progression. Tout semble se passer comme si l'activité des voies de signalisation réglant l'équilibre entre polymérisation et dépolymérisation de l'actine dépendaient de la forme de la particule endocytée. Lorsque le phagosome est clos, le réseau sous membranaire d'actine à son niveau est en grande partie désassemblé (plus de fluorescence rouge).
Il y a probablement intervention de myosine de différentes classes au cours de l'endocytose.